
行業信息
蔗糖合酶(Sucrose Synthase, SS)活性的測定通常基于其催化蔗糖分解為果糖和UDP-葡萄糖的反應。以下是常用的測定方法:
1. 原理
蔗糖合酶催化以下反應:

通過測定反應產物(果糖或UDP-葡萄糖)的生成量,可以計算蔗糖合酶的活性。
2. 儀器與試劑
儀器
分光光度計:用于測定吸光度。
恒溫水浴:控制反應溫度(通常為30°C或37°C)。
離心機:用于分離反應液。
移液管:1 mL、5 mL、10 mL。
試管:用于反應和測定。
試劑
蔗糖:底物。
UDP:底物。
果糖標準溶液:用于繪制標準曲線。
DNS試劑(3,5-二硝基水楊酸):用于測定還原糖。
緩沖液(pH 7.0):如Tris-HCl或磷酸緩沖液。
酶提取液:從樣品中提取蔗糖合酶。
3. 測定步驟
3.1 酶提取
樣品處理:
取植物組織(如葉片或根),洗凈并切碎。
加入預冷的提取緩沖液(如50 mM Tris-HCl, pH 7.0),勻漿。
離心:
將勻漿液在4°C下離心(10,000 g,15分鐘)。
取上清液作為酶提取液。
3.2 酶反應
反應體系:
在試管中加入以下成分:
0.5 mL酶提取液
0.5 mL 100 mM蔗糖溶液
0.5 mL 10 mM UDP溶液
1.5 mL緩沖液(pH 7.0)
反應:
將試管放入30°C或37°C恒溫水浴中,反應30分鐘。
終止反應:
加入2 mL DNS試劑,煮沸5分鐘,終止反應并顯色。
冷卻至室溫。
3.3 測定
離心:
將反應液離心(3000 rpm,10分鐘),取上清液。
測定吸光度:
在540 nm波長下測定上清液的吸光度。
4. 標準曲線繪制
配制標準系列:
分別取0、0.2、0.4、0.6、0.8、1.0 mL果糖標準溶液,加入試管中。
分別加入1 mL緩沖液和1 mL DNS試劑。
反應與測定:
煮沸5分鐘,冷卻至室溫。
在540 nm波長下測定吸光度。
繪制標準曲線:
以果糖濃度為橫坐標,吸光度為縱坐標,繪制標準曲線。
5. 計算
計算果糖濃度:
根據樣品吸光度,從標準曲線中查得果糖濃度 CC(mg/mL)。
計算酶活性:
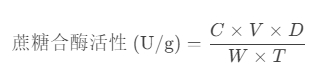
其中:
CC:果糖濃度(mg/mL)。
VV:反應液體積(mL)。
DD:稀釋倍數。
WW:樣品重量(g)。
TT:反應時間(h)。
6. 注意事項
樣品處理:確保樣品新鮮,避免酶活性損失。
反應溫度:嚴格控制反應溫度,避免影響酶活性。
DNS試劑:DNS試劑需現配現用,避免失效。
重復測定:每個樣品至少重復測定三次,取平均值。
空白對照:每次測定需設置空白對照(用蒸餾水代替酶提取液)。
7. 參考標準
GB/T 35882:植物酶活性測定方法。
ISO 5725:測定方法的精密度和準確度。
NEWS
新聞動態service
科研服務18537125967