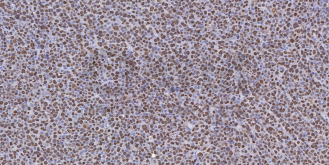
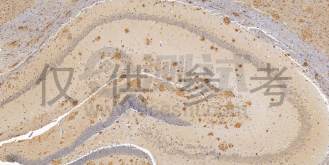
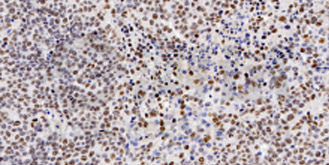
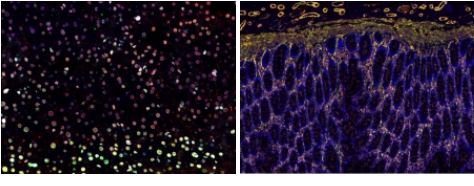
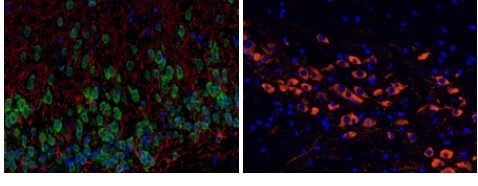
1、免疫組化
是應用免疫學基本原理——抗原抗體反應,即抗原與抗體特異性結合的原理,通過化學反應使標記抗體的顯色劑(熒光素、酶、金屬離子、同位素)顯色來確定組織細胞內抗原(多肽和蛋白質),對其進行定位、定性及定量的研究,稱為免疫組織化學技術( immunohistochemistry,IHC)。
2、免疫熒光
免疫熒光技術是在免疫學、生物化學和顯微鏡技術的基礎上建立起來的一項技術。它是根據抗原抗體反應的原理,先將已知的抗原或抗體標記上熒光基團,再用這種熒光抗體(或抗原)作為探針檢查細胞或組織內的相應抗原(或抗體)。
免疫組化染色/免疫熒光染色送樣要求:
1.包埋:石蠟包埋、OTC包埋。
(1)標本要求:已固定在4%多聚甲醛中的動物組織,或已固定在FAA中的植物組織。
(2)送樣要求:
a. 動物組織:處死動物后立即取材,生理鹽水沖洗表面,4%的多聚甲醛固定,一般組織固定48h左右進行包埋z好,大小不超過1cm*1cm*0.5cm,裝組織的管子一定要比組織大,固定液是樣品體積的5倍以上,以保證充分固定,封口膜封好避免運輸過程中固定液灑出。
注:常溫或少量冰袋運輸。
2.切片:石蠟切片、冰凍切片。
(1)標本要求:已包埋的動物。
(2)送樣要求:
a. 石蠟包埋的組織:冰袋運輸。
b. OTC包埋的組織:干冰運輸。
3.染色:
a. 石蠟切片:脫蠟至水、抗原修復、血清封閉、一抗孵育、二抗孵育、染核、脫水、透明、封片。
b. 冰凍切片:清洗去除OTC、血清封閉、一抗孵育、二抗孵育、染核、脫水、透明、封片。
(1)標本要求:切片。
(2)送樣要求:
a. 石蠟切片:石蠟切片碼齊裝在塑料切片盒中,冰袋運輸。
b. 冰凍切片:冰凍切片碼齊裝在塑料切片盒中,干冰運輸。
4.拍照:普通熒光拍照、熒光數字掃描、激光共聚焦(免疫可拍攝)。
(1)標本要求:已染色的切片。
(2)送樣要求:已染色的切片,常溫或少量冰袋運輸。
1、免疫組化:
1、免疫組化產生組織切片非特異性染色的原因
a. 抗體孵育時間過長、抗體濃度高易增加背景著色。這可通過縮短一抗/二抗孵育時間、稀釋抗體來控制。這是重要的一條;
b. 一抗用多克隆抗體易出現非特異性著色,建議試用單克隆抗體看看;
c. 內源性過氧化物酶和生物素在肝臟、腎臟等組織含量很高(含血細胞多的組織),需要通過延長滅活時間和增加滅活劑濃度來降低背景染色;
d. 非特異性組分與抗體結合,這需要通過延長二抗來源的動物免疫血清封閉時間和適當增加濃度來加強封閉效果;
e. DAB孵育時間過長或濃度過高;
f. PBS沖洗不充分,殘留抗體結果增強著色,在一抗、二抗或SP孵育之后的浸洗尤為重要;
g. 標本染色過長中經常出現干片,這容易增強非特異性著色。
2、免疫組化背景過深的原因
可能是一抗濃度高;需要調整DAB孵育時間;考慮血清封閉的時間是否過短;適當增加抗體孵育后的浸洗次數和延長浸洗時間等。
3、用免疫熒光方法做組織切片和培養細胞內的蛋白兩者有何不同?
只是固定方法不同。細胞固定用甲醇,切片固定用多聚甲醛,而染色方法是一樣的。
4、間接法免疫熒光染色如何設置對照?
z好是同一視野在未用熒光激發下進行對照,看是否非特異性染色,具體包括:
(1)空白對照:如果你做的是石蠟切片免疫組化,這個對照必須有,目的是看自發熒光,脫蠟后直接在熒光顯微鏡下觀察。
(2)陰性對照:標本直接滴加二抗,呈陰性反應。
(3)抗原對照:標本加同種動物的未免疫血清,以 PBS 沖洗后,在加抗免疫球蛋白熒光抗體。因未免疫動物的血清中無特異性抗體,應呈陰性反應。

 儀器型號
儀器型號