蛋白質(zhì)含量的測(cè)定是生物化學(xué)、分子生物學(xué)、臨床醫(yī)學(xué)以及食品科學(xué)等多個(gè)領(lǐng)域中不可或缺的基本實(shí)驗(yàn)步驟。準(zhǔn)確測(cè)量蛋白質(zhì)濃度對(duì)于保證下游實(shí)驗(yàn)如Western Blot、ELISA、免疫沉淀等實(shí)驗(yàn)結(jié)果的可靠性至關(guān)重要。
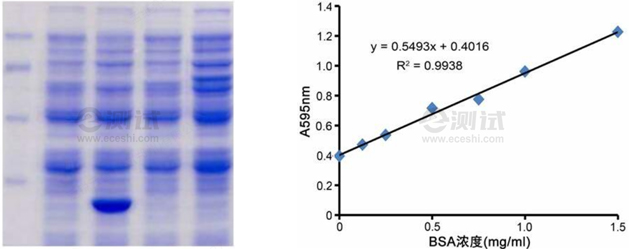
1、Bradford法(考馬斯亮藍(lán)):Bradford法基于蛋白質(zhì)與考馬斯亮藍(lán)G-250染料在特定條件下形成穩(wěn)定的復(fù)合物,其z大吸收峰會(huì)發(fā)生顯著變化,通過(guò)分光光度計(jì)測(cè)定吸光值的變化即可計(jì)算出蛋白質(zhì)濃度。
(1)實(shí)驗(yàn)準(zhǔn)備
- 準(zhǔn)備不同已知濃度的標(biāo)準(zhǔn)蛋白溶液以繪制標(biāo)準(zhǔn)曲線。
- 配制Bradford試劑(市售即用型或按廠家說(shuō)明配制)。
(2)操作步驟
- 取若干微孔板,每孔加入一定量待測(cè)蛋白樣品及一系列標(biāo)準(zhǔn)蛋白溶液。
- 向各孔加入等體積的Bradford試劑,混勻后在室溫靜置一段時(shí)間(通常為5-10分鐘)。
- 使用分光光度計(jì)在595nm波長(zhǎng)下測(cè)定各孔的吸光值。
- 以標(biāo)準(zhǔn)蛋白濃度為橫坐標(biāo),以對(duì)應(yīng)的吸光值為縱坐標(biāo),繪制標(biāo)準(zhǔn)曲線。
2、BCA法:基于雙縮脲原理,堿性條件下蛋白質(zhì)將Cu2+還原成Cu+,BCA鰲合Cu+作為顯色劑,產(chǎn)生藍(lán)紫色并在562nm有吸收峰,單價(jià)Cu+與蛋白質(zhì)呈劑量相關(guān)性。可以根據(jù)待測(cè)蛋白在562nm處的吸光度計(jì)算待測(cè)蛋白濃度。
(1)實(shí)驗(yàn)準(zhǔn)備
- a. 取0.8ml蛋白標(biāo)準(zhǔn)配制液加入到一管蛋白標(biāo)準(zhǔn)(20mg BSA)中,充分溶解后配制成25mg/ml的蛋白標(biāo)準(zhǔn)溶液。配制后可立即使用,也可以-20oC長(zhǎng)期保存。
- b. 取適量25mg/ml蛋白標(biāo)準(zhǔn)液,稀釋至終濃度為0.5mg/ml。例如取20μl 25mg/ml蛋白標(biāo)準(zhǔn),加入980μl稀釋液即可配制成 0.5mg/ml蛋白標(biāo)準(zhǔn)。蛋白樣品在什么溶液中,標(biāo)準(zhǔn)品也宜用什么溶液稀釋。但是為了簡(jiǎn)便起見(jiàn),也可以用0.9% NaCl或PBS 稀釋標(biāo)準(zhǔn)品。稀釋后的0.5mg/ml蛋白標(biāo)準(zhǔn)可以-20oC長(zhǎng)期保存。
(2)操作步驟
- a. 將標(biāo)準(zhǔn)品按0、1、2、4、8、12、16、20μl加到96孔板的標(biāo)準(zhǔn)品孔中,加標(biāo)準(zhǔn)品稀釋液補(bǔ)足到20μl,相當(dāng)于標(biāo)準(zhǔn)品濃度分 別為0、0.025、0.05、0.1、0.2、0.3、0.4、0.5mg/ml。
- b. 加適當(dāng)體積樣品到96孔板的樣品孔中。如果樣品不足20μl,需加標(biāo)準(zhǔn)品稀釋液補(bǔ)足到20μl。請(qǐng)注意記錄樣品體積。
- c. 各孔加入200μl BCA工作液,37oC放置20-30分鐘。 注: 也可以室溫放置2小時(shí),或60oC放置30分鐘。BCA法測(cè)定蛋白濃度時(shí),顏色會(huì)隨著時(shí)間的延長(zhǎng)不斷加深。并且顯色反 應(yīng)會(huì)因溫度升高而加快。如果濃度較低,適合在較高溫度孵育,或適當(dāng)延長(zhǎng)孵育時(shí)間。
- d. 用酶標(biāo)儀測(cè)定A562,或540-595nm之間的其他波長(zhǎng)的吸光度。
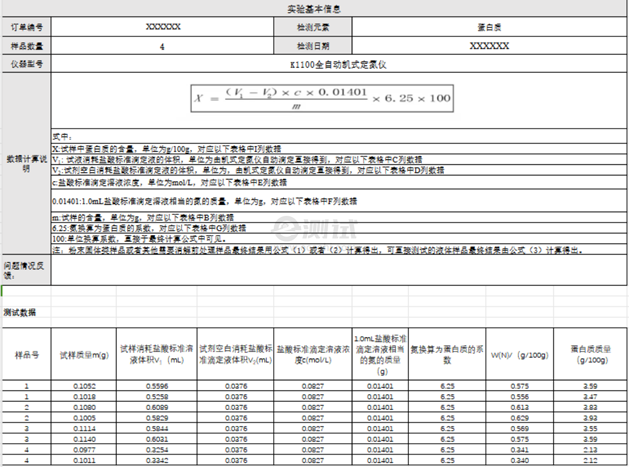
- e. 根據(jù)標(biāo)準(zhǔn)曲線和使用的樣品體積計(jì)算出樣品的蛋白濃度。 3、凱氏定氮法 它是通過(guò)測(cè)定樣品中的總氮含量間接反映蛋白質(zhì)總量的一種方法,因?yàn)榈鞍踪|(zhì)含氮量相對(duì)恒定(約16%)。當(dāng)樣本與濃硫酸共熱,蛋白氮轉(zhuǎn)化為銨鹽,在強(qiáng)踐行條件下將氨整出,用加有指示劑的硼酸吸收,z后用標(biāo)準(zhǔn)酸滴定硼酸,通過(guò)標(biāo)準(zhǔn)酸的用量即可求出蛋白質(zhì)中的含氮量和蛋白質(zhì)含量。 總結(jié)來(lái)說(shuō),不同的蛋白含量測(cè)定方法各有優(yōu)劣,選擇合適的方法取決于實(shí)驗(yàn)需求、靈敏度要求以及可能存在的干擾因素。在實(shí)際操作時(shí),務(wù)必遵循安全操作規(guī)程,并對(duì)實(shí)驗(yàn)結(jié)果進(jìn)行必要的校正和驗(yàn)證。
樣本量要求:3-5g或者5-10mL,為防止蛋白樣品降解,需低溫寄送保存,避免反復(fù)凍融。
服務(wù)周期:一般為樣品接收后的1周,具體實(shí)驗(yàn)周期及送樣時(shí)間請(qǐng)與e測(cè)試工作人員溝通確認(rèn),謝謝!
交付內(nèi)容:提供原始數(shù)據(jù)及圖片。結(jié)果反饋請(qǐng)?jiān)跍y(cè)試完成一周內(nèi),不建議回收樣品,如有需要請(qǐng)?zhí)崆胺答伣oe測(cè)試工作人員。
Bradford測(cè)試/ BCA測(cè)試
凱氏定氮法測(cè)試
用凱氏定氮法測(cè)試蛋白,如果同時(shí)有兩種蛋白怎么換算?
同時(shí)含有多種蛋白質(zhì),且折算系數(shù)不相同時(shí)可以按復(fù)合配方食品換算蛋白質(zhì)系數(shù)。凱氏定氮法經(jīng)典、準(zhǔn)確,適用于食品中蛋白質(zhì)的測(cè)定。但是因樣品中一般會(huì)含有一些非蛋白質(zhì)的含氮化合物,所以凱氏定氮法測(cè)定結(jié)果為樣品中粗蛋白質(zhì)含量。然而,此法實(shí)際上測(cè)的不是蛋白質(zhì)含量,而是通過(guò)測(cè)氮含量來(lái)推算出樣品中蛋白質(zhì)的含量。

 當(dāng)前位置:首頁(yè) > 科研服務(wù)> 生理生化平臺(tái)> 蛋白質(zhì)含量測(cè)試
當(dāng)前位置:首頁(yè) > 科研服務(wù)> 生理生化平臺(tái)> 蛋白質(zhì)含量測(cè)試 
 儀器型號(hào)
儀器型號(hào)