
行業信息
大腸桿菌(Escherichia
coli)作為革蘭氏陰性菌的代表,廣泛用于抗菌材料、消毒劑及抗生素的抑菌效能評估。抑菌圈實驗(又稱瓊脂擴散法)通過測量抑菌劑周圍透明區域的直徑,直觀反映其抑制微生物生長的能力。本文基于CLSI(臨床和實驗室標準協會)指南與ISO
20776-1標準,系統解析大腸桿菌抑菌圈實驗的操作流程、數據解讀及質控要點,為抗菌產品研發與效能驗證提供科學依據。
一、實驗原理與核心要素
1. 基本原理
擴散-抑制模型:抑菌劑在瓊脂培養基中擴散,形成濃度梯度,抑制大腸桿菌生長,產生透明抑菌圈。
抑菌圈直徑:與抑菌劑濃度、擴散速率及細菌敏感性呈正相關,滿足公式:
D = klogC+b
(D:抑菌圈直徑;C:抑菌劑濃度;k、b:實驗常數)
2. 實驗方法選擇
紙片擴散法(Kirby-Bauer法):適用于液態或可溶固態樣品,標準化濾紙片(直徑6mm)負載待測物。
牛津杯法:適合黏稠或難溶樣品,不銹鋼杯(內徑8mm)嵌入瓊脂中加樣。
打孔法:直接在瓊脂平板打孔(孔徑5~6mm)注入樣品,成本低但精度稍遜。
二、實驗材料與設備
菌株與培養基
標準菌株:E. coli ATCC 25922(質控菌株,確保實驗可比性)。
培養基:Mueller-Hinton Agar(MHA),pH 7.2~7.4,厚度4mm(誤差±0.5mm)。
菌液制備:0.5麥氏比濁度(~1×10? CFU/mL),生理鹽水稀釋至1×10? CFU/mL。
抑菌劑處理
液體樣品:過濾除菌(0.22μm濾膜),梯度稀釋(如100%、50%、25%)。
固體樣品:溶解于適宜溶劑(如DMSO、無菌水),終濃度≤1%(避免溶劑抑菌干擾)。
儀器與耗材
恒溫培養箱(35±1℃)、游標卡尺(精度0.1mm)、無菌鑷子、牛津杯/濾紙片。
三、標準化操作流程
1. 實驗步驟
平板制備:
傾注MHA培養基(15~20mL/平板),冷卻凝固后表面干燥(37℃孵育30分鐘)。
菌液涂布:
取100μL稀釋菌液均勻涂布于瓊脂表面,靜置5分鐘吸附。
加樣:
紙片法:無菌鑷子貼附含樣濾紙片(間距≥24mm,距平板邊緣≥15mm);
牛津杯法:輕壓牛津杯至瓊脂表面,注入50μL樣品液,避免溢出。
培養與觀察:
倒置平板,35℃培養16~18小時,測量抑菌圈直徑(含紙片/牛津杯尺寸)。
2. 關鍵控制點
培養基厚度均一:厚度偏差>0.5mm可導致擴散速率差異,影響重復性。
菌液濃度精準:比濁儀校準后使用,確保菌落數在(50~100)CFU/cm2。
擴散時間控制:加樣后平板靜置10分鐘(預擴散),再移入培養箱。
四、結果判讀與效能分級
測量方法
游標卡尺垂直測量抑菌圈邊緣(以完全抑制區為準,忽略微弱生長區),取三次測量平均值。
邊緣模糊處理:若抑菌圈呈霧狀,以80%抑菌效果處為邊界。
效能評價標準
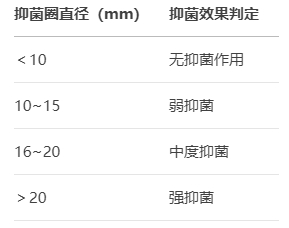
MIC關聯分析
通過抑菌圈直徑與z小抑菌濃度(MIC)建立回歸曲線,預測未知樣品MIC值(需預先標定)。
五、質量控制與疑難解析
1. 質控要求
陽性對照:0.5μg/mL環丙沙星紙片(E. coli ATCC 25922抑菌圈應為30~40mm)。
陰性對照:無菌溶劑(如生理鹽水)應無抑菌圈。
重復性:同一樣品三次平行實驗,抑菌圈直徑偏差≤1.5mm。
2. 常見問題與對策
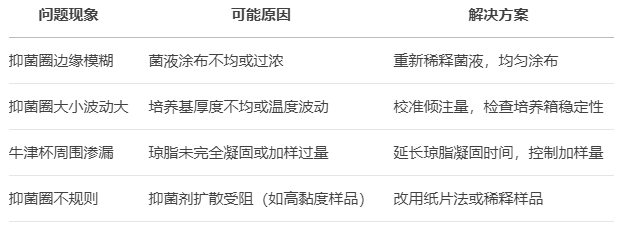
六、應用場景與實驗拓展
抗菌產品研發
評估新型抗菌劑(如納米材料、植物提取物)的廣譜抑菌能力。
篩選復合配方的協同抑菌效應(多抑菌劑聯合作用)。
醫療與日化領域
醫用敷料、消毒劑、洗手液的抑菌效能驗證(參照《消毒技術規范》)。
化妝品防腐劑效果測試(ISO 11930標準)。
環境監測
水體、食品加工環境中大腸桿菌的抗菌劑敏感性監測,指導用藥策略。
七、技術創新與標準化趨勢
自動化測量系統
圖像分析軟件(如ImageJ)自動識別抑菌圈邊緣,減少人為誤差。
高通量平臺:96孔板同步測試,提升檢測效率。
標準化擴展
引入CLSI M100文件更新判讀標準,適應耐藥菌株變化。
結合qPCR技術檢測抑菌后細菌存活率,驗證抑菌圈結果可靠性。
三維抑菌模型
構建含生物被膜的瓊脂模型,模擬真實環境中細菌的抑菌響應。
NEWS
新聞動態service
科研服務18537125967