
行業信息
一、雙縮脲法核心原理與適用場景
基本原理:
蛋白質中的肽鍵在堿性條件下與Cu2?結合形成紫色絡合物,在540nm波長處具有最大吸光度,濃度與吸光值呈正比(比爾定律)。
獨特優勢:
檢測范圍寬(1-10mg/mL)
不受游離氨基酸干擾
操作耗時短(20分鐘出結果)
成本低廉(試劑配制成本<0.5元/樣)
適用領域:
? 食品工業(乳制品/肉制品質檢)
? 生物醫藥(疫苗純度檢測)
? 科研實驗(細胞裂解液蛋白定量)
二、實驗步驟詳解(附關鍵參數)
2.1 試劑配制規范
雙縮脲試劑配方:
A液:10% NaOH溶液(需新鮮配制)
B液:0.5% CuSO?·5H?O + 1.5% 酒石酸鉀鈉(避光保存)
臨用前按A:B=50:1混合,現配現用
2.2 標準曲線制作
牛血清白蛋白(BSA)梯度設置:
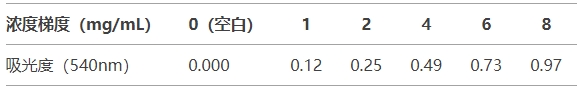
注:R2應>0.995,線性區間驗證通過
2.3 樣品測定流程
樣品處理:
液態樣品:離心(3000rpm×10min)取上清
固態樣品:按1:10(w/v)加PBS勻漿
顯色反應:
取1mL樣品 + 4mL雙縮脲試劑 → 混勻靜置15min
比色測定:
用1cm比色皿讀取540nm吸光值(空白調零)
三、數據計算與誤差控制
3.1 濃度計算公式
標準曲線法:
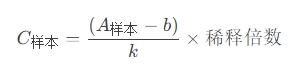
k: 標準曲線斜率
bb: 截距值
3.2 誤差來源及對策
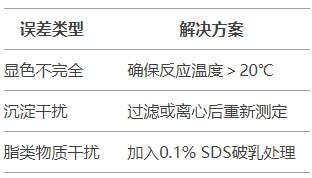
四、7大常見問題權威解答(FAQ)
Q1:為什么顯色后溶液渾濁?
? 可能原因:蛋白質變性沉淀 → 需縮短顯色時間或降低反應溫度
Q2:檢測結果比實際值偏低?
? 排查步驟:
檢查試劑有效期(新配試劑需靜置24h穩定)
驗證標準品是否降解(-20℃分裝保存)
Q3:能否檢測含Tris緩沖液的樣品?
? 需控制Tris濃度<0.05M,否則會絡合Cu2?導致顯色減弱
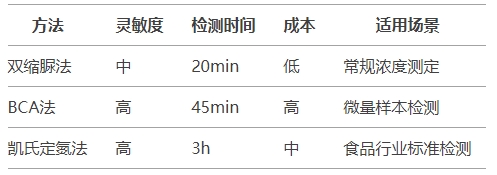
五、技術進階與替代方案對比
5.1 方法對比表
5.2 自動化改進方案
微孔板檢測:適配酶標儀實現96孔板高通量檢測
預制試劑盒:商業化試劑盒(如碧云天C5030)誤差率<3%
NEWS
新聞動態service
科研服務18537125967